

造模机制: 通过结扎引起模型动物的冠状动脉狭窄或闭塞,使该冠脉所供应的心肌缺血、坏死,从而引起模型动物心肌梗死。
造模方法:
1、简要的来说,一般冠状动脉结扎术主要分为三步:
2、首先,动物在麻醉后,在第四肋间行左胸开胸术;然后小心地将心包膜打开,在左心耳尖远端结扎左冠状动脉前降支(left anterior descending,LAD),如果结扎成功的话。心电图(electrocardiogram,ECG)则显示典型的ST段抬高,而观察左心室前壁也会变白;
3、最后关闭胸腔。如需制作心肌缺血再灌注损伤模型,可在结扎LAD后30分钟再去除结扎,引起缺血再灌注损坏。
大鼠:
1、选用成年Wistar大鼠,体重250g左右,39/L戊.芭.比.妥.钠10ml/kg进行腹腔注射,插管前给予啊托.品 20~30μg/kg腹腔注射。先行气管插管,连接呼吸机;
2、大鼠仰卧位四肢固定好,去毛,上界为胸骨上缘水平,下界为胸骨下缘水平。消毒铺单后,以心尖搏动最强点为中心,沿胸骨左缘3mm左右作一约1.5~2.0cm长纵形切口,逐层开胸进入胸腔。
3、剪开心包膜,暴露左心耳,从左心耳下方2~3mm入针,结扎的中点在左心耳和肺动脉圆锥的交界上。 结扎方向与左心耳边缘平行,而且与房室交界线垂直。
4、进针深度1.5~2.0mm,由于大鼠冠状动脉细小不易于心肌分离,通常用缝合线连同部分心肌一起结扎,结扎的力度适中以防止损伤心肌或血管。把心脏放回胸腔,迅速缝合胸壁。停止人工呼吸。
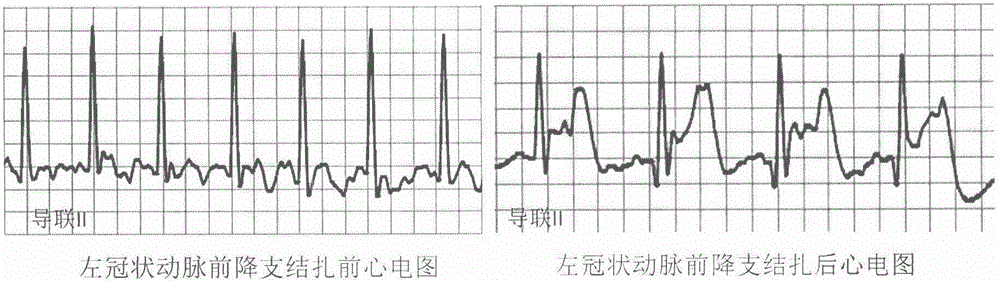
5、造模成功的标志是心壁的颜色变白和心电图监测ST段抬高。
小鼠:
1、选用25~30g小鼠。腹腔内注射戊.芭.比.妥.钠(50mg/kg)。
2、待小鼠麻醉后将其用胶布固定于操作板上。剃净胸部毛发,70%乙醇消毒,在直视下将22G套管针送入气管,重建气道,呼吸频率设置于100~110次/min。
3.取左侧胸骨正中线,垂直肋骨,剪开皮肤。逐层分离胸大肌,胸小肌,在小鼠的呼气相分别剪断等
三、四、五肋骨,使用开胸器将胸骨撑开、固定,暴露心脏,剪开心包膜,
4、在显微镜下寻找左前降支,在左房下缘1mm左右,跨度1mm左右以10.0的眼科缝合线结扎左前降支。
5、观察心电图ST-T改变及心肌颜色变化,拆除开胸器,以8-0的无创经合线关闭胸腔,缝合皮肤,术后维持呼吸机约30分钟,待小鼠清醒后撤机。
模型特点:
冠脉结扎法是一种最常用的复制心肌梗死模型的方法,也是研究心肌缺血损伤公认的模型。结扎法制作心梗动物模型的范围较为清楚、效果确切,可根据研究需要对心脏不同的区域进行造模,并能通过心电图、 病理学、血清酶学等对造模过程进行实时监控和评估。
然而,结扎法需要对动物进行开胸操作,并涉及气管插管、麻醉和术后护理等外科操作,过程复杂并对外 科技术和设备要求高,并不适用于普通实验室造模研究。创伤大,对动物影响大。此外,术后动物高死亡率会进一步增加造模成本,有研究表示术后动物死亡率可高达60%。
模型评估和应用:
临床上绝大多数心肌梗死都是冠状动脉粥样硬化造成的,动脉粥样硬化不稳定斑块出血后形成血栓是造成冠状动脉闭塞的病理基础。
人类心肌缺血50%发生于左前降支供血区域,因此结扎冠脉引起的急性心肌缺血动物模型临床相似度高, 可用于研究心肌缺血后血流动力学和心肌代谢的改变,也可用于研究预防及治疗心肌缺血的药物。
但结扎法造成心肌梗死并无这种病理基础,开胸术也引起动物产生一些生理、生化指标改变,使模型动物与临床心肌梗死发病有一定区别。但是,结扎法确切的造模效果和精确的控制,仍然有其特定运用空间。
本模型适用于要求心肌损伤改变与临床相似,或需要精确控制梗死时间和范围的研究;由于造模过程相对复杂,需要有一定外科设备和技术基础的实验室来承担。


