

造模机制
通过结扎引起模型动物的冠状动脉狭窄或闭塞,使该冠脉所供应的心肌缺血、坏死,从而引起模型动物心肌梗死。
造模方法
简要的来说,一般冠状动脉结扎术主要分为三步:
1、首先,动物在麻醉后,在第四肋间行左胸开胸术;
2、然后小心地将心包膜打开,在左心耳尖远端结扎左冠状动脉前降支(left anterior descending,LAD),如 果结扎成功的话。心电图(electrocardiogram,ECG)则显示典型的ST段抬高,而观察左心室前壁也会变白;
3、最后关闭胸腔。如需制作心肌缺血再灌注损伤模型,可在结扎LAD后30分钟再去除结扎,引起缺血再灌注损坏。
具体造模方法以下列几个动物为例:
猪:
1、选用18~22kg小型猪,先应用30g/L戊巴bi妥在猪耳缘静脉推注3~5ml使猪镇静,3~5分钟后猪站立不稳而卧倒。
2、然后迅速用套管针在猪耳缘静脉建立静脉通路,并缓慢推注30g/L戊巴bi妥(1ml/kg)麻醉后,将动物取仰卧位置于介入室手术台。
3、分离暴露气管,气管插管。连接呼吸机。沿胸骨第四肋间开胸,暴露心脏,提起心包纵向切开并做心包床。
4、离LAD主干中下1/3交界处,并在其下穿根丝线备用于结扎。
5、将4个多点固定式心外膜电极衬片缝在心脏表面,多导生理记录仪描记结扎前、结扎后心外膜电图,以ST段升高为造模成功标准。
6、关闭胸腔,撤出呼吸机。
犬:
1、一般选用比格犬,体重10~18kg,动物称重后以3%戊巴bi妥钠30mg/kg静脉注射麻醉,右侧位固定于手术台。
2、气管插管,连接呼吸机。
3、一般选用比格犬,体重10~18kg,动物称重后以3%戊巴bi妥钠30mq/kg静脉注射麻醉,右侧位固定于手术台。
4、气管插管,连接呼吸机。
5、沿胸骨左缘第4或第5肋间开胸,暴露心脏,剪开心包并做心包床,
6、分离LAD主干中下1/3交界处,并在其下穿根丝线备用于结扎。
7,在心脏表面缝上多点固定式心外膜电极衬片,多导生理记录仪描记结扎前,结扎后心外膜电图,以ST段升高为造模成功标准。
8、关闭胸腔,撤出呼吸机,按需要处理动物。
大鼠:
1、选用成年Wistar大鼠,体重250g左右,39/L戊巴bi妥钠10ml/kg进行腹腔注射,插管前给予atropine 20 ~30μg/kg腹腔注射。
2、先行气管插管,连接呼吸机;大鼠仰卧位四肢固定好,去毛,上界为胸骨上缘水平,下界为胸骨下缘水平。
、消毒铺单后,以心尖搏动最强点为中心,沿胸骨左缘3mm左右作一约1.5~2.0cm长纵形切口,逐层开胸进入胸腔。
4、剪开心包膜,暴露左心耳,从左心耳下方2~3mm入针,结扎的中点在左心耳和肺动脉圆锥的交界上。
5、结扎方向与左心耳边缘平行,而且与房室交界线垂直。
6、进针深度1.5~2.0mm,由于大鼠冠状动脉细小不易于心肌分离,通常用缝合线连同部分心肌一起结扎,结扎的力度适中以防止损伤心肌或血管。
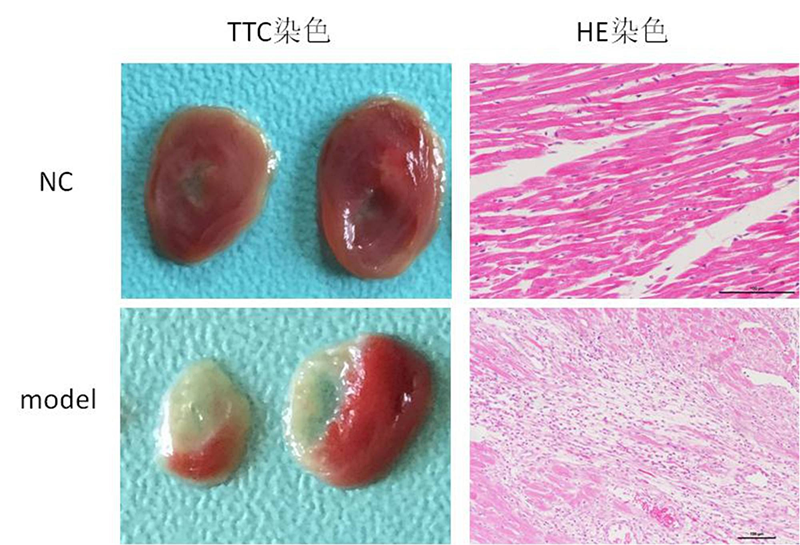
7、把心脏放回胸腔,迅速缝合胸壁。停止人工呼吸。 造模成功的标志是心壁的颜色变白和心电图监测ST段抬高。
小鼠:
1、选用25~30g小鼠。腹腔内注射戊巴bi妥钠(50mg/kg)。
2、待小鼠麻醉后将其用胶布固定于操作板上。剃净胸部毛发,70%乙醇消毒,在直视下将22G套管针送入气管,重建气道,呼吸频率设置于100~110次/min。
3、取左侧胸骨正中线,垂直肋骨,剪开皮肤。
4、逐层分离胸大肌、胸小肌,在小鼠的呼气相分别剪断第三、四、五肋骨,使用开胸器将胸骨撑开、固定,暴露心脏,剪开心包膜。
5、在显微镜下寻找左前降支,在左房下缘1mm左右、跨度1mm左右以10.0的眼科缝合线结扎左前降支。
6、观察心电图ST-T改变及心肌颜色变化。
7、拆除开胸器,以8-0的无创缝合线关闭胸腔。
8、缝合皮肤,术后维持呼吸机约30分钟,待小鼠清醒后撤机。
需确认的信息
1. 模型种属(大鼠还是小鼠或是其他种属)
2. 动物体重有无要求,年龄有无要求
3. 雌雄有无要求
4. 模型构建具体方案
5. 取材要求(采血、取组织样本)


